- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
外泌体:已经有研究报道了各种Hh的胞外转运机制,但实际用于体内Hh分泌和转运的途径尚不清楚。该研究显示Hh在果蝇翅膀成虫盘的分泌依赖于运输所需的内体分选复合物(ESCRT)。在体内,产生Hh的细胞中ESCRT活性的降低导致外部细胞表面保留Hh。此外,产生Hh的细胞中的ESCRT活性对于长距离信号传导是必需的。证据表明Hh和ESCRT蛋白质的库在体内一起分泌到细胞外空间中,并且随后可以在受体细胞的表面一起被检测到。这些发现揭示了ESCRT蛋白质在控制形态发生活性中的新功能,揭示了一种新的机制,通过细胞外囊泡在组织中转运分泌的Hh,这是长距离靶向诱导所必需的。利用不同截留相对分子质量(MWCO)的超滤膜对样品进行选择性分离,便可获得外泌体。太原外泌体提取试剂供应商
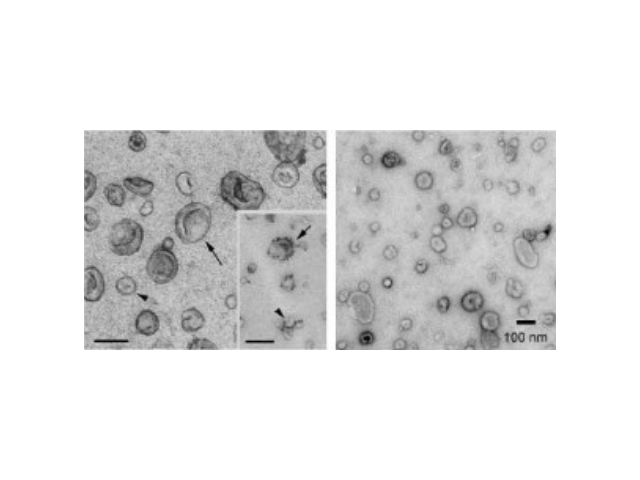
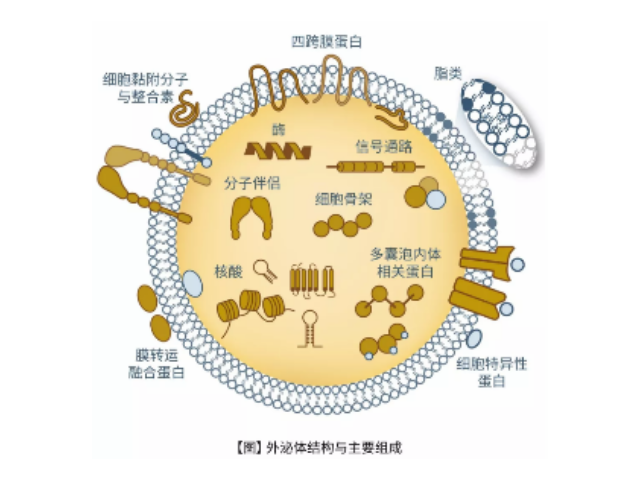
外泌体(Exosome)是从体液(尿液、血液、唾液、腹水、胸腹水等)和细胞液中快速提取的,其是活细胞分泌到胞外的囊泡样小体,含有多种蛋白和核酸分子(DNA、RNA、以及miRNA),在体内细胞间物质和信号转导中起到重要作用。由于这些核酸被囊膜包裹而被保护,稳定性高,不易降解,是一种用于一些病症诊断和预后监测的非常理想的新型生物标记物一些疾病的早期诊断、用药监控、预后判断。近年来,随着人们对外泌体的研究和认识加深,外泌体检测作为一种新型的液体活检热点技术已被许多临床科研机构普遍地应用于一些病症和疾病的无创诊断、治病和监测;如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键。北京外泌体提取试剂直销厂家这些试剂盒不需要特殊设备,随着产品不断更新换代,提取效率和纯化效果逐渐提高。

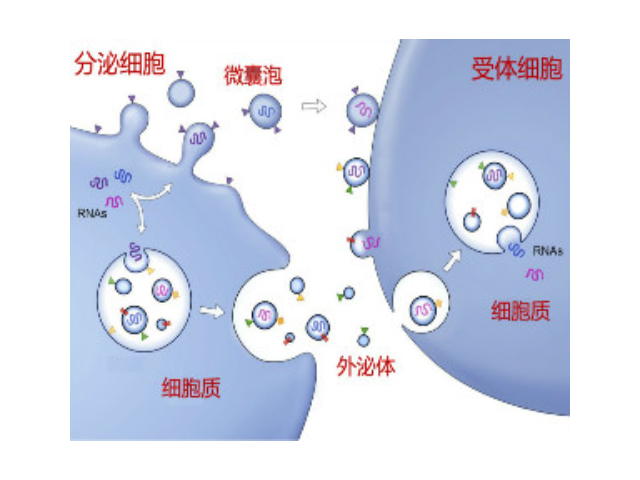
外泌体富含胆固醇和鞘磷脂。2007年,Valadi等发现鼠的肥大细胞分泌的exosome可以被人的肥大细胞捕获,并且其携带的mRNA成分可以进入细胞浆中可以被翻译成蛋白质,不仅*是mRNA,exosomes所转移的microRNA同样具有生物活性,在进入靶细胞后可以靶向调节细胞中mRNA的水平。这一发现使得研究人员对exosome的研究热情激增,截止目前已经通过286项研究发现了41860种蛋白质、2838种microRNA、3408种mRNA。1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。现今,其特指直径在40-100nm的盘状囊泡。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。
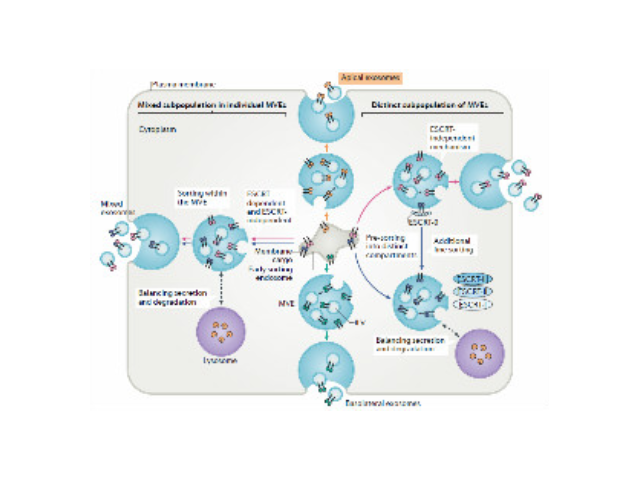
外泌体不断地被细胞产生和吸收。它们可能是新生成的外泌体和消耗的外泌体的混合物(红色和蓝色)。目前尚不清楚内生性产生或消耗的外泌体是一起释放还是单独释放。外泌体与生殖发育,抗细菌:人类的生殖,妊娠和胚胎发育需要精确,微调和动态的细胞间通讯。**,羊水,血液和母乳均含有具有特定功能的外泌体:精浆来源的外泌体与生殖器免疫有关,还有助于阻断HIV的传染;胎盘滋养细胞来源的外泌体可将一类miRNA输送至非胎盘细胞,促进自噬和细菌防御机能;母乳来源的外泌体也对婴儿的免疫系统有帮助。将沉淀物用PBS缓冲液进行悬浮,使外泌体悬浮于液体上层。
外泌体在肺病进程中的作用:肺病细胞来源外泌体(LCC-exosome)可以通过刺激一些病症血管的形成来促进一些病症的生长。据相关报道称,LCC-exosome中的miR-210可以通过调节基质细胞中酪氨酸受体激酶A3的含量,促进一些病症血管的生成;而LCC-exosome中的miR-23a则可以通过启动脯氨酰羟化酶及压制紧密结合蛋白ZO-1来促进肺病的生血管作用。此外,有研究发现,外泌体中的内容物可以触发上皮-间质转化(EMT)。晚期肺病患者血清中外泌体波形蛋白表达增加,促使人正常支气管上皮细胞出现EMT,从而使肺支气管正常上皮细胞出现增殖,迁移能力。对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。合肥外泌体提取试剂进货价
主要来源于细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。太原外泌体提取试剂供应商
外泌体与肺病预后:在当代精细医疗的大趋势下,外泌体的发现和研究为肺病的早期诊断和治病提供了崭新的方向。外泌体在液体活检中的巨大潜力可以为肺病患者的早期发现和早期诊疗提供可靠依据。根据一些病症来源的外泌体在肺病的发生的发展和侵袭转移过程中的作用及相关机制的研究,临床医疗人员可以针对不同的患者制定较合适的治病方案,以达到改善肺病患者生存率,延长肺病患者生存时间的目的。但是,针对外泌体的研究还存在诸多的问题有待广大研究者解决,如:外泌体的纯化及标记方法、如何寻找外泌体的靶基因、外泌体的作用机制及信号通路等。总而言之,外泌体的研究有着广阔的前景,基于外泌体与肺病的研究,有望研发出能够应用于肺病临床诊断和治病的有效措施,造福更多的患者。太原外泌体提取试剂供应商
用于外泌体提取的体液收集注意事项:1、抽血技巧。操作要轻柔迅速。试管可翻转8-10次使样本与抗凝剂混匀,避免剧烈摇晃。混匀后,将试管固定垂直放置于离心分离器,在顶部记录抽血的准确时间,因为抽血与离心之间的时间间隔可能是一个影响因素。外泌体在抽血后30分钟内是比较稳定的,若时间过长将导致外泌体数量增加。血小板极易因抽血时的物理因素而并释放出外泌体,其中包括接触、压力、切力。2、抽血时间。除了血液黏度,体内血液的各项指标在1天中变化很大。生理节律会对血小板的产生很大的影响。白细胞的募集和循环系统中促炎细胞和细胞会随时间变化。大量的具有特殊表面分子的微粒也被证明会随时间变化。目前尚无设计较好的实验对...
- 郑州正规外泌体提取试剂哪家好 2025-12-22
- 厦门外泌体提取试剂价格 2025-12-22
- 昆明正规外泌体提取试剂直销厂家 2025-12-22
- 贵阳外泌体提取试剂哪里买 2025-12-22
- 贵阳外泌体提取试剂 2025-12-22
- 宁波正规外泌体提取试剂服务电话 2025-12-22
- 贵阳正规外泌体提取试剂厂家 2025-12-22
- 长沙外泌体提取试剂哪里买 2025-12-21
- 无锡正规外泌体提取试剂厂家批发价 2025-12-21
- 天津正规外泌体提取试剂销售厂家 2025-12-21
- 太原外泌体提取试剂厂家 2025-12-21
- 厦门外泌体提取试剂报价 2025-12-20
- 成都正规外泌体提取试剂哪家便宜 2025-12-20
- 太原正规外泌体提取试剂平均价格 2025-12-18
- 济南正规外泌体提取试剂报价 2025-12-15
- 上海外泌体提取试剂哪里买 2025-12-14


- 成都无血清细胞冻存液销售厂家 12-23
- 济南正规细胞外基质胶 12-23
- 武汉正规外泌体提取试剂厂家推荐 12-23
- 芜湖重庆RNA提取试剂 12-23
- 金华鼠尾胶原产品介绍 12-22
- 合肥RNA提取试剂直销厂家 12-22
- 昆明原代细胞分离试剂盒厂家供应 12-22
- 无锡正规鼠尾胶原厂家供应 12-22
- 南昌正规细胞外基质胶产品介绍 12-22
- 郑州正规外泌体提取试剂哪家好 12-22