- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
外泌体作为RNAi药物载体的疗效:这项研究,检测了利用exosomes作为RNAi靶向药物的效果,并证明了这个过程中exosomes进行免疫逃逸的机制:对exosomes进行基因修饰(命名为iExosome),装载上靶向胰腺病细胞KRAS突变基因的RNA干扰药物,在小鼠模型上进行试验,结果表明,iExosome比同样经过修饰的脂质iLiposome递送效果更好,能够压制侵袭性胰腺病生长;这得益于exosomes表面的CD47,它能够阻止exosomes在血液循环系统中被单核细胞清理。这项研究结果对致力于exosomes转化医学的科学家来说,可谓振奋人心!逐渐取代超速离心法并推广开来。有些试剂盒操作简便,不用超速离心。贵阳正规外泌体提取试剂直销价
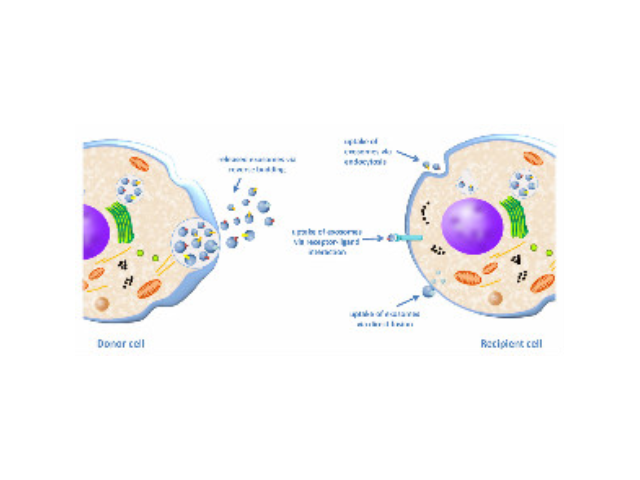
人体几乎所有类型的细胞都能分泌外泌体,外泌体普遍存在并分布于各种体液中,携带多种蛋白质、mRNA、miRNA和脂质类物质等,作为重要的传递信号分子,形成了一种全新的细胞-细胞间信息传递系统,可参与细胞通讯、细胞迁移、血管新生和一些病症细胞生长等过程。外泌体与微泡:我们知道,细胞间相互作用可以通过释放蛋白质、核酸、脂质等分子到胞外与受体结合从而介导胞内细胞传导。除此之外,细胞还可以释放膜囊泡,外泌体与微泡就是其中两种,二者相似但形成方式不同:外泌体是细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中的膜囊泡,而微泡则是细胞出芽与细胞膜融合后直接脱落形成的囊泡,且外泌体大小均一,直径在40~100nm,其大小取决于其起源部位以及细胞中的脂质双层结构;而微泡大小不一,直径在50~1000nm之间。郑州正规外泌体提取试剂厂家直销在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。
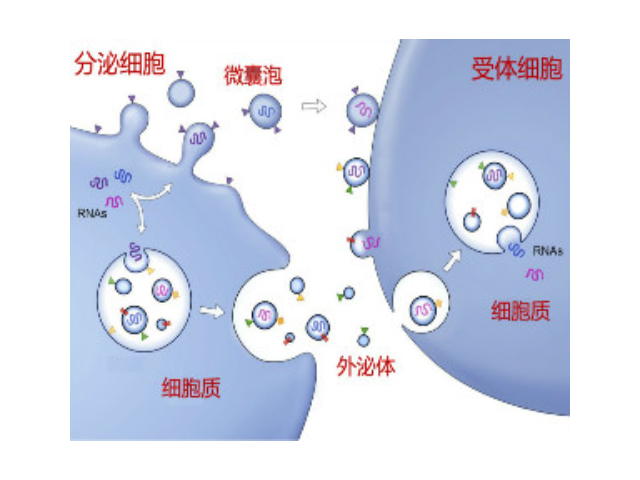
外泌体项目获批学科方向:从统计来看,与前年相似外泌体立项集中的领域还是一些病症学,近年来外泌体发表的文章也绝大部分与其在一些病症的形成,耐药性,检测等方面有关。例如2019年发表在MolecularCancer(IF=10.679)上的文章表明外泌体FMR1-AS1通过TLR7/NFκB/c-My信号通路在女性食管ai中促进维持ai症干细胞样细胞的动态平衡。发表在JournalofExperimental&ClinicalCancerResearch(IF=5.646)上的一篇文章发现外泌体转运p-STAT3可促进结直肠ai细胞获得性5-FU耐药性。发表在Cancers(IF=6.162)上的一篇文章则研究了腹腔灌洗液中细胞外囊泡相关的miRNA作为子宫内膜ai分子标志物的可能性。此外,在神经系统和精神疾病,中医学及其他领域也有不少外泌体相关项目中标。
外泌体相关miRNA与肺病的诊断:miRNAs是一类含有20~25个核苷酸的非编码小RNA,能够通过下调或压制靶mRNAs来调节转录水平上的基因表达,目前非编码RNA被普遍发现存在于NSCLC患者外泌体中,参与一些病症的形成和演化过程。单个miRNA可能通过压制性复合物与多个mRNA结合,从而阻滞整个生物通路。因此,外泌体的miRNA具有成为NSCLC标志物的优势。Chen等在152例肺病患者的研究中初次报道了循环游离miRNA的表达,与75例健康者相比,发现了两种高表达的miRNA(miR-25和miR-223)。Rabinonowits等对27例肺病患者和9例健康人的血浆外泌体中12个miRNA的表达进行了评估,结果显示,12个一些病症相关的miRNA*在肺病患者中过度表达。Cazzoli等收集了30个血浆样本,发现4种外泌体miRNA(miR-378a、-379a、-139-5p、-200b-5p)在肺病患者血清中明显升高,用于筛查患者与健康人ROC曲线下面积(AUC)为0.908。外泌体(Exosome)是从体液(尿液、血液、唾液、腹水、胸腹水等)和细胞液中快速提取的。
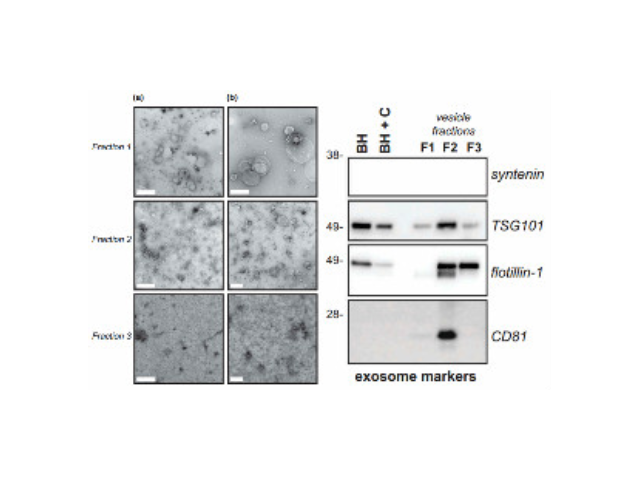
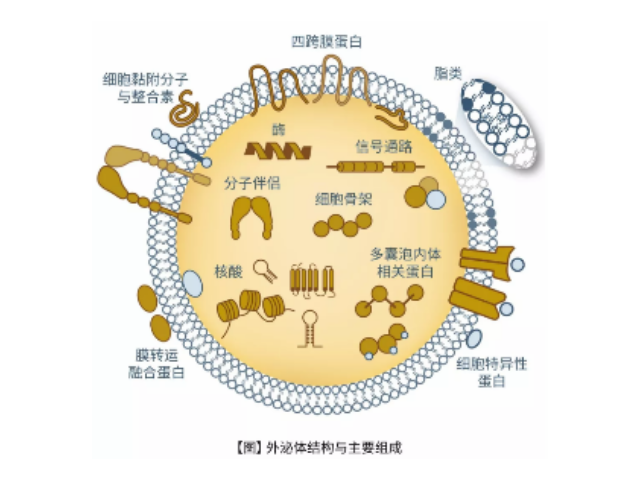
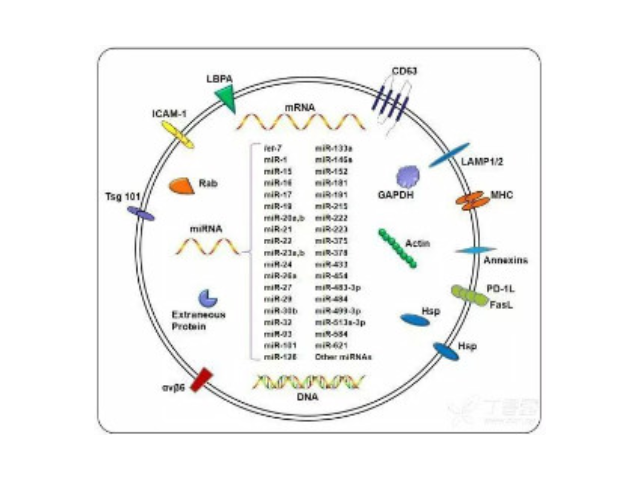
外泌体的组成:外泌体主要含有融合蛋白和转运蛋白、热休克蛋白(HSP70)、CD类蛋白以及磷脂酶和其他脂质相关蛋白,但是不同来源的外泌体的组成有差异。外泌体的提取方式:1、离心法:此种方法得到的外泌体量多,但是纯度不足。2、过滤离心:这种操作简单、省时,不影响外泌体的生物活性,但同样纯度不足。3、密度梯度离心法:用此种方法分离到的外泌体纯度较高,但是前期准备工作繁杂。4、免疫磁珠法:这种方法可以保证外泌体形态的完整,特异性高、操作简单,但生理性盐浓度会影响外泌体生物活性。5、色谱法:此种方法分离出的外泌体大小均一,但设备特殊,应用不普遍。外泌体生物活性易受pH和盐浓度影响,不利于下游实验,难以普遍普及。长沙正规外泌体提取试剂厂家推荐
由于这些核酸被囊膜包裹而被保护,稳定性高,不易降解。贵阳正规外泌体提取试剂直销价
研究初次发现疟原虫传染小鼠血浆外泌体(exosomes)能够压制一些病症血管生成,并初步阐明其分子机制。研究加深了对疟原虫传染宿主所分泌的外泌体与一些病症血管生成之间的相互作用的认识,为开发疟原虫传染来源的外泌体作为一种新型抗一些病症制剂奠定了基础。研究人员选用肺病小鼠模型作为研究对象,从传染疟原虫的小鼠血浆中获得外泌体,并将这些外泌体注射到小鼠的一些病症内部,并与没有疟原虫传染的小鼠血浆外泌体进行对照。研究发现,疟原虫传染小鼠的血浆外泌体明显压制一些病症血管的生成。进一步的研究发现,疟原虫传染的小鼠血浆外泌体通过至少四种特殊的微小RNA(miR16-5p/17-5p/322-5p/497-5p)压制血管内皮细胞VEGF受体(VEGFR2)的表达从而阻断血管生成的信号通路。这些发现加深了人们对疟原虫抗病机理的理解,并为疟原虫疗法治病一些疾病的临床研究提供进一步的理论依据。贵阳正规外泌体提取试剂直销价
由欧洲多国细胞外囊泡领域的学者发起并成立的国际细胞外囊泡协会(ISEV)于2014年在协会会刊JournalofExtracellularVesicles发表了一个指导性意见,也就是我们常说的MISEV2014。2018版《指导要求》进行了修订。2018版的《指导要求》首先讨论了对这些细胞来源的非细胞具膜结构如何称呼。学者们普遍认为应当使用细胞外囊泡(extracellularvesicle)来称呼这些具膜囊泡,当我们使用常规方法分离这些结构时不推荐使用其他的名称来称呼它们。通过离心筛选初步去除体液中的细胞成分和细胞碎片,制成体液样本备用。唐山外泌体提取试剂厂家供应外泌体作为近几年来的研究热点...
- 贵阳外泌体提取试剂报价 2025-12-27
- 徐州正规外泌体提取试剂生产厂家 2025-12-27
- 深圳外泌体提取试剂哪家好 2025-12-27
- 长沙外泌体提取试剂厂家供应 2025-12-27
- 金华外泌体提取试剂厂家批发价 2025-12-27
- 深圳外泌体提取试剂推荐厂家 2025-12-26
- 深圳正规外泌体提取试剂厂家直销 2025-12-26
- 武汉正规外泌体提取试剂推荐厂家 2025-12-26
- 杭州外泌体提取试剂销售厂家 2025-12-26
- 贵阳外泌体提取试剂厂家推荐 2025-12-26
- 杭州正规外泌体提取试剂厂家推荐 2025-12-25
- 成都正规外泌体提取试剂进货价 2025-12-25
- 金华正规外泌体提取试剂直销价 2025-12-24
- 南昌外泌体提取试剂直销价 2025-12-24
- 郑州外泌体提取试剂哪家便宜 2025-12-24
- 南昌外泌体提取试剂哪家便宜 2025-12-24


- 徐州南昌细胞高效转染试剂 12-31
- 苏州细胞高效转染试剂厂家直销 12-30
- 青岛鼠尾胶原哪里买 12-30
- 宁波深圳细胞高效转染试剂 12-30
- 长沙细胞高效转染试剂报价 12-30
- 昆明细胞高效转染试剂直销厂家 12-30
- 昆明正规细胞高效转染试剂厂家直销 12-30
- 合肥细胞高效转染试剂生产厂家 12-30
- 开封正规细胞高效转染试剂产品介绍 12-30
- 长沙正规细胞高效转染试剂厂家批发价 12-30